Periodieke Tabel Kernpunte
Hier is ‘n vinnige oorsig op wat ons in hierdie gids sal dek:
- Die Periodieke Tabel van die elemente is ‘n meesterkaart wat al 118 bekende chemiese elemente organiseer.
- Elemente word gerangskik volgens hul toenemende atoomgetal, wat die aantal protone in ‘n atoom se kern verteenwoordig.
- Die tabel se uitleg onthul patrone in die eienskappe van die elemente, soos reaktiwiteit en elektronkonfigurasie.
- Vertikale kolomme word groepe genoem, wat soortgelyke chemiese gedrag deel.
- Horisontale rye, bekend as periodes, dui die aantal elektronskille aan wat ‘n element se atome besit.
Inleiding
Het jy al ooit gewonder hoe wetenskaplikes tred hou met al die boustene van materie? Die antwoord is die Periodieke Tabel van die elemente, ‘n fundamentele kaart in Chemie. Hierdie kragtige hulpmiddel organiseer al die bekende chemiese elemente op ‘n logiese en maklik verstaanbare manier. Dit rangskik hulle volgens hul unieke atoomgetal, wat ons help om patrone en verhoudings met ‘n oogopslag te sien. Dink daaraan as die uiteindelike kitsgids vir die begrip van alles, van die lug wat ons inasem tot die metale in ons fone.
Die Doel en Belangrikheid van die Periodieke Tabel
Die Periodieke Tabel is veel meer as net ‘n kleurvolle kaart; dit is ‘n noodsaaklike instrument om te voorspel hoe elemente sal optree en interaksie hê. Die skepper van die Periodieke Tabel, Dmitri Mendeleev, het elemente eers in 1869 volgens hul atoommassa georganiseer en opgemerk dat sekere chemiese eienskappe periodiek herverskyn.
Hierdie eenvoudige waarneming het Chemie gerevolusioneer. Vandag is die moderne Periodieke Tabel onontbeerlik in beide teoretiese en toegepaste Chemie, wat wetenskaplikes en studente toelaat om verhoudings tussen elemente te verstaan sonder om elke enkele feit te memoriseer. Dit is die padkaart vir alle chemiese verkenning. Hieronder sal ons ondersoek waarom chemici daarop staatmaak en hoe dit help om elementgedrag te voorspel.
Waarom Elke Chemikus die Periodieke Tabel Gebruik
Vir enige chemikus is die Periodieke Tabel van die elemente ‘n fundamentele verwysing. Net soos ‘n wêreldkaart vir ‘n geograaf, bied dit noodsaaklike konteks om die wêreld van materie te navigeer. Organisasies soos die American Chemical Society (ACS) erken dit as ‘n hoeksteen van chemiese onderwys en navorsing. Die struktuur daarvan maak voorsiening vir ‘n vinnige beoordeling van ‘n element se waarskynlike chemiese eienskappe bloot deur na sy ligging te kyk.
Die tabel se waarde lê in sy organiserende krag. Toe Dmitri Mendeleev sy weergawe in die laat 19de eeu ontwikkel het, het hy selfs spasies gelaat vir elemente wat nog nie ontdek is nie, en hul eienskappe korrek voorspel. Hierdie voorspellende vermoë was ‘n reuse-deurbraak en het die belangrikheid van die tabel vasgelê.
Vandag, vanaf studente wat die basiese beginsels leer tot navorsers wat nuwe materiale ontwikkel, gebruik almal die tabel om verhoudings te verstaan, reaksies te voorspel en die groot hoeveelheid inligting oor die elemente te organiseer. Dit bly die belangrikste dokument in Chemie.
Hoe Dit Help om Elementeienskappe te Voorspel
Een van die kragtigste kenmerke van die Periodieke Tabel is die vermoë daarvan om te help om die eienskappe van die elemente te voorspel. Deur ‘n element se posisie te verstaan, kan jy ingeligte aannames maak oor sy gedrag. Byvoorbeeld, elemente in dieselfde kolom (groep) is geneig om ‘n soortgelyke oksidasietoestand te hê, wat beskryf hoe hulle met ander elemente kan bind.
Oorspronklik is elemente volgens atoomgewig gesorteer, maar die moderne tabel gebruik die atoomgetal. Hierdie verandering het die voorspellende akkuraatheid van die tabel verfyn. Nou kan tendense in eienskappe soos atoomradius, elektronegatiwiteit en ionisasie-energie duidelik gesien word soos jy oor rye en af in kolomme beweeg. Interaktiewe Periodieke Tabelle wat aanlyn beskikbaar is, soos dié van PubChem, laat jou toe om hierdie tendense onmiddellik te visualiseer. [1]
Hierdie patrone spaar chemici daarvan om eindelose teoretiese berekeninge of eksperimente uit te voer. In plaas daarvan kan hulle die tabel as ‘n beginpunt gebruik om te hipoteseer hoe ‘n stof kan reageer, wat sy smeltpunt kan wees, of dit elektrisiteit sal gelei, alles gebaseer op gevestigde periodieke tendense.
Hoe Elemente op die Periodieke Tabel Georganiseer Is
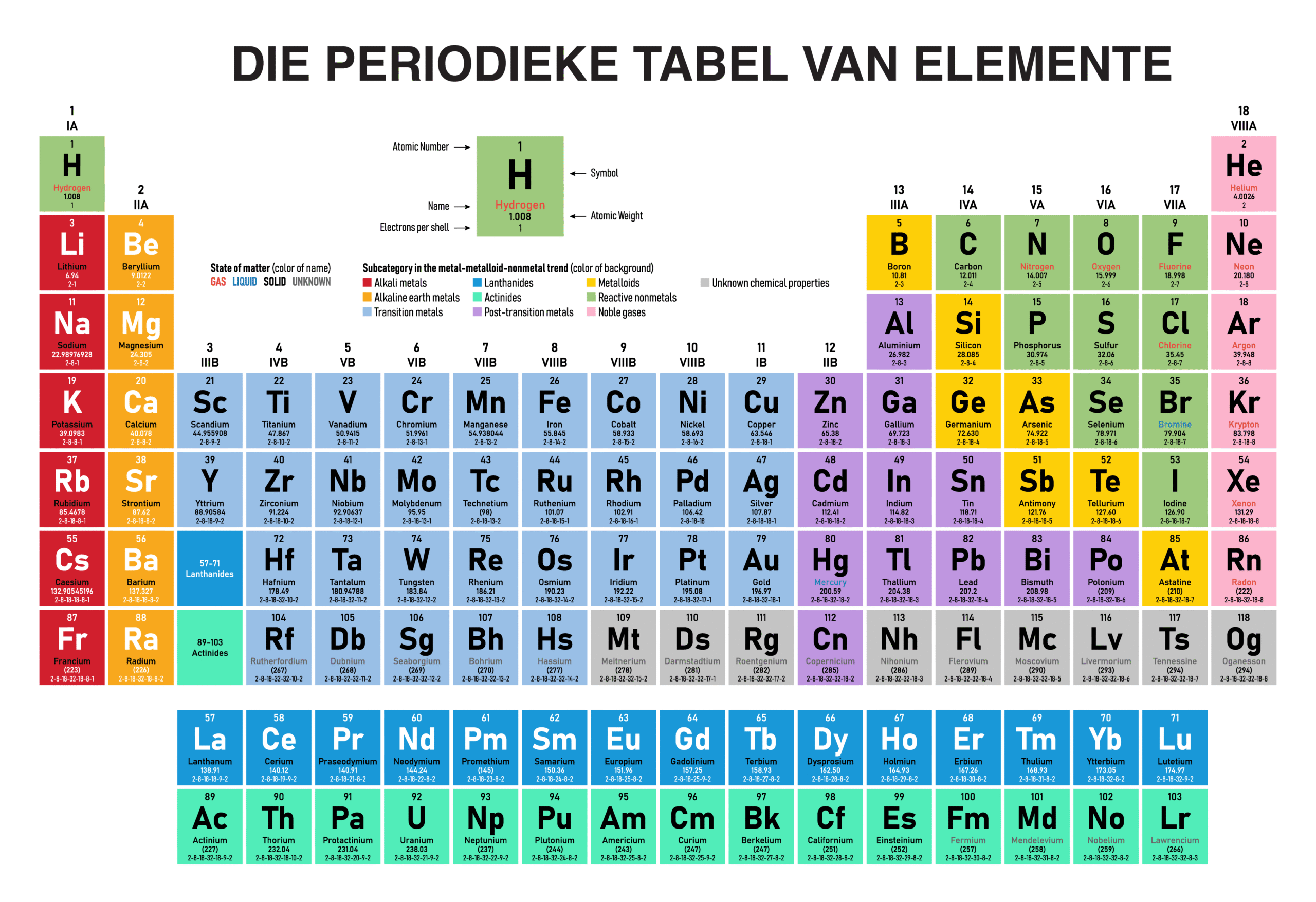
Die organisasie van die Periodieke Tabel is wat dit so nuttig maak. Elemente word gerangskik in volgorde van toenemende atoomgetal, beginnende met waterstof by 1 en beweeg van links na regs oor die kaart. Hierdie uitleg is nie willekeurig nie; dit is gestruktureer in rye en kolomme wat diep verbindings tussen die elemente onthul.
Die horisontale rye word periodes genoem, en die vertikale kolomme staan bekend as groepe van elemente. Die tabel is ook verdeel in afdelings genaamd blokke. ‘n Element se posisie verskaf ‘n magdom inligting oor sy atoomstruktuur en chemiese gedrag. Ons sal nou dieper kyk na hierdie strukturele komponente en wat dit vir ons sê.
Periodieke Tabel van elemente met name en simbole
Uitleg: Groepe, Periodes en Blokke Verduidelik
Om die uitleg van die Periodieke Tabel te verstaan begin mens met sy hoofkomponente: periodes, groepe en blokke. Die horisontale rye word periodes genoem. Alle elemente binne dieselfde periode het dieselfde aantal elektronskille, wat die bane is wat elektrone om die atoom se kern volg. Soos jy oor ‘n periode beweeg, kry elemente een proton en een elektron by.
Die vertikale kolomme is die groepe, genommer 1 tot 18. Elemente in dieselfde groep deel soortgelyke chemiese eienskappe omdat hulle dieselfde aantal elektrone in hul buitenste skil het. Dit is waarom elemente in ‘n groep dikwels op soortgelyke maniere reageer. Sommige sleutelgroepe het spesiale name:
- Groep 1: Die alkalimetalelemente (behalwe waterstof) is hoogs reaktief.
- Groep 2: Alkali-aardmetalelemente, reaktief maar minder as die alkalimetalelemente.
- Groepe 3-12: Dit staan bekend as die oorgangsmetalelemente.
- Groep 17: Halogene, hoogs reaktiewe nie-metale.
- Groep 18: Die edelgasse is baie nie-reaktief.
Ten slotte word die tabel in s-, p-, d- en f-blokke verdeel. Hierdie blokke stem ooreen met die tipe atoomorbitaal wat die buitenste elektrone beset, wat verder help om ‘n element se eienskappe te klassifiseer en te voorspel.
Elemente in Periodieke Tabel – Hul Posisie en Wat Dit Oor Reaktiwiteit Onthul
‘n Element se posisie op die Periodieke Tabel is ‘n direkte leidraad tot sy reaktiwiteit. Oor die algemeen is reaktiwiteit die hoogste vir metale heel links (soos natrium) en nie-metale regs bo (soos fluoor), terwyl die elemente in die middel en heel regs minder reaktief is. Hierdie neiging is nou gekoppel aan ‘n element se atoomstruktuur.
Die elementposisie bepaal byvoorbeeld sy atoomradius, of die grootte van sy atome. Soos jy teen ‘n groep af beweeg, neem die atoomradius toe, wat dit makliker maak vir die atoom om ‘n buitenste elektron te verloor en te reageer. Omgekeerd, as jy oor ‘n periode van links na regs beweeg, hou atome hul elektrone stywer vas, wat beïnvloed hoe hulle bind.
Die mees stabiele elemente is die edelgasgroep heel regs. Hul buitenste elektronskille is vol, wat hulle baie onwillig maak om met enigiets te reageer. Hierdie stabiliteit is ‘n doelwit vir ander elemente, wat reageer om ‘n soortgelyke elektronkonfigurasie te bereik. Die konsep van ‘n stabiele isotoop, wat nie radioaktiewe verval ondergaan nie, is ‘n ander laag van stabiliteit wat volgens element verskil.
Dekodering van Simbole en Nommers op die Periodieke Tabel van Elemente
Elke vierkant op die Periodieke Tabel bevat sleutelinligting oor ‘n element, aangebied in ‘n snelskrifformaat. Jy sal tipies ‘n elementsimbool sien, wat ‘n afkorting van een of twee letters is, tesame met ‘n paar belangrike nommers. Hierdie datastukke is die grondslag vir die begrip van die element se identiteit.
Die mees prominente nommers is die atoomgetal en die atoommassa. Saam met die simbool bied hulle ‘n momentopname van die element se kerneienskappe en sy plek in die heelal van Chemie. Kom ons breek af wat elkeen van hierdie komponente beteken.
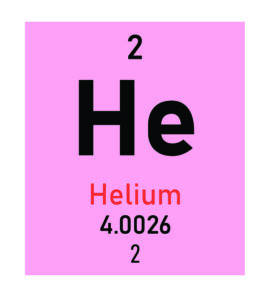
Wat Elke Elementsimbool Verteenwoordig
Aan elke element word unieke name en simbole toegewys wat universeel deur wetenskaplikes gebruik word. Die simbool is ‘n afkorting van een of twee letters wat afgelei is van die element se naam, wat in Engels, Latyn, of ‘n ander taal kan wees. Byvoorbeeld, die eerste element, waterstof, het die simbool ‘H,’ terwyl goud die simbool ‘Au‘ van sy Latynse naam, aurum, het.
Hierdie simbole is noodsaaklik vir die skryf van chemiese formules en vergelykings. Hulle bied ‘n eenvoudige manier om die 118 bekende chemiese elemente voor te stel sonder om hul volle name elke keer uit te skryf. Alhoewel baie stowwe wat ons teëkom verbindings is, kan ‘n paar elemente, soos goud en koolstof, in hul suiwer vorm in die natuur gevind word.
Die benaming van nuwe elemente word oorgesiendeur die Internasionale Unie van Suiwer en Toegepaste Chemie (IUPAC). Hier is ‘n paar voorbeelde van elemente en hul simbole:
Element Naam | Simbool |
Waterstof | H |
Helium | He |
Koolstof | C |
Suurstof | O |
Goud | Au |
Betekenis van Atoomgetal en Massa
Die atoomgetal, wat gewoonlik bo-aan ‘n element se boks gevind word, is die belangrikste identifiseerder. Dit verteenwoordig die aantal protone in die kern van ‘n enkele atoom van daardie element. Aangesien elke element ‘n unieke aantal protone het, definieer die atoomgetal die element. Byvoorbeeld, enige atoom met 6 protone is ‘n koolstofatoom.
In ‘n neutrale atoom is die atoomgetal ook gelyk aan die aantal elektrone wat om die kern wentel. Hierdie balans is deurslaggewend vir die begrip van ‘n element se chemiese bindingsgedrag. Die Periodieke Tabel is gerangskik in volgorde van toenemende atoomgetal, wat die periodieke patrone van eienskappe skep.
Die ander sleutelgetal is die atoommassa. Hierdie waarde is die geweegde gemiddelde massa van al die natuurlike isotope van ‘n element. Vir elemente met geen stabiele isotope nie, word die massagetal van die mees stabiele isotoop dikwels in plaas daarvan gelys. Hierdie nommer weerspieël die totale telling van protone en neutrone in die kern.
Verkenning van Elementgroepe en Hul Soortgelyke Gedrag
Een van die mees fassinerende aspekte van die Periodieke Tabel is hoe dit elemente met soortgelyke eienskappe in vertikale kolomme organiseer. Hierdie elementgroepe is soos families, waar elke lid sleutelkenmerke met die ander deel. Dit is omdat hulle almal dieselfde aantal elektrone in hul buitenste skil het.
Hierdie gedeelde chemiese eienskappe beteken dat elemente in dieselfde groep dikwels op voorspelbare maniere reageer en verbindings met ‘n soortgelyke oksidasietoestand vorm. Die verkenning van hierdie groepe help om die studie van Chemie te vereenvoudig van 118 individuele elemente na ‘n handvol verwante families. Kom ons ondersoek sommige van hierdie groepe en hul algemene gedrag.
Alkali-, Aardalkali-, Oorgangs- en Ander Groepe
Die Periodieke Tabel se 18 groepe is die tuiste van verskeie bekende elementfamilies, elk met sy eie kenmerkende identiteit. Die elemente in Groep 1 is die hoogs reaktiewe alkalimetale-familie (met die uitsondering van waterstof). Net langsaan in Groep 2 is die aardalkalimetalelemente, wat ook reaktief is, maar minder as hul bure.
Die groot blok oorgangsmetalelemente strek oor die middel van die tabel van Groepe 3 tot 12. Hierdie groep sluit bekende metale soos yster, koper en goud in, wat bekend is vir hul sterkte en die vermoë om kleurvolle verbindings te vorm.
Ander belangrike groepe sluit die halogene in Groep 17 en die edelgasse in Groep 18 in. Daarbenewens word twee rye dikwels afsonderlik onderaan die tabel getoon:
- Die lantaniede en aktiniede staan bekend as die innerlike oorgangsmetale.
- Baie hiervan word as seldsame aardelemente beskou, met die aktiniede wat radioaktief
Gedeelde Chemiese Eienskappe Binne Groepe
Elemente binne dieselfde groep vertoon soortgelyke eienskappe omdat hulle dieselfde aantal valenselektrone deel—die elektrone in die buitenste skil. Hierdie elektrone is die primêre drywers van ‘n element se chemiese gedrag, aangesien dit diegene is wat betrokke is by die vorming van bindings met ander atome. Byvoorbeeld, elke element in Groep 1 het een valenselektron, wat dit geneig is om maklik te verloor, wat hierdie elemente hoogs reaktief maak.
Hierdie gedeelde elektroniese strukture lei tot voorspelbare patrone in chemiese eienskappe. Elemente in ‘n groep het dikwels dieselfde algemene oksidasietoestand, wat beteken dat hulle geneig is om dieselfde aantal elektrone te kry, te verloor of te deel wanneer hulle verbindings vorm. Dit is hoekom natrium (Na) en kalium (K), albei in Groep 1, soortgelyke verbindings soos NaCl en KCl vorm.
Alhoewel hul fisiese eienskappe, soos smeltpunt en digtheid, kan verander soos jy teen ‘n groep af beweeg, bly hul fundamentele chemiese aard konsekwent. Hierdie beginsel van terugkerende eienskappe is die essensie van die periodieke wet en maak die tabel ‘n ongelooflik kragtige voorspellende hulpmiddel.
Gevolgtrekking
Ter opsomming, die Periodieke Tabel is nie net ‘n versameling elemente nie; dit is ‘n fundamentele hulpmiddel wat insig gee in die gedrag en verhoudings van verskillende stowwe. Die begrip van die uitleg, simbole en groepe daarvan kan jou vermoë verbeter om chemiese reaksies te voorspel en die ingewikkelde wêreld van Chemie te begryp. Deur die betekenis van elementorganisasie en die eienskappe wat hulle deel, te herken, kan jy ‘n dieper waardering vir hierdie wetenskaplike wonder ontwikkel. As jy gretig is om dieper in die wêreld van Chemie te duik, moet asseblief nie huiwer om meer hulpbronne of kundige leiding te soek om jou kennis verder te verryk nie. Lekker verken!
Gereelde Vrae
Waar kan ek ‘n drukbare Periodieke Tabel aflaai?
Jy kan hoëgehalte, drukbare weergawes van die Periodieke Tabel van die elemente op verskeie wetenskaplike webwerwe vind. Organisasies soos die American Chemical Society (ACS) en openbare databasisse soos PubChem bied gratis, aflaaibare PDF’s aan wat dikwels besonderhede soos die mees stabiele isotoop vir elke element insluit.
Wat is ‘n paar wenke vir die memorisering van die elemente en hul simbole?
Vir die memorisering van elemente, probeer om mnemoniese toestelle of liedjies te gebruik om hulle in volgorde van atoomgetal te onthou. Flitskaarte is ‘n klassieke hulpmiddel om ‘n elementsimbool by sy naam te pas. Baie webwerwe bied ook interaktiewe speletjies aan wat die leer van die tabel pret en innemend maak.
Hoe het die Periodieke Tabel verander namate nuwe elemente ontdek is?
Die Periodieke Tabel is ‘n lewende dokument wat groei namate ‘n nuwe element ontdek word. Die Internasionale Unie van Suiwer en Toegepaste Chemie (IUPAC) is verantwoordelik vir die validering van ontdekkings, dikwels van sintetiese elemente wat via radioaktiewe verval geskep word, en om dit amptelik te benoem. [2] Die tabel het aansienlik uitgebrei sedert die eerste element geïdentifiseer is.
Verwysings: [1] PubChem. “Periodic Table of Elements.” National Center for Biotechnology Information. https://pubchem.ncbi.nlm.nih.gov/ptable/ [2] “About.” International Union of Pure and Applied Chemistry. https://iupac.org/about/



